Для чего нужны индикаторы?
Изначально свойство данных соединений изменять цвет в различной среде широко применялось для визуального определения кислотно-основных свойств веществ в растворе, что помогало определить не только характер среды, но и сделать вывод об образующихся продуктах реакции. Растворы индикаторов продолжают использоваться в лабораторной практике для определения концентрации веществ методом титрования и позволяют научиться использовать подручные способы за неимением современных pH-метров.
Существует несколько десятков подобного рода веществ, каждый из которых чувствителен к довольно узкой области: обычно она не превышает 3 пунктов по шкале информативности. Благодаря такому многообразию хромофоров и их малой активности между собой ученым удалось создать универсальные индикаторы, широко применяемые в лабораторных и производственных условиях.
АДСОРБЦИОННЫЕ ИНДИКАТОРЫ
Адсорбционные индикаторы — вещества, в присутствии которых происходит изменение цвета осадка, образующегося при титровании методом осаждения. Изменять цвет осадка при определенном значении pH способны многие кислотно-щелочные индикаторы, некоторые красители и другие химические соединения, что делает их пригодными для использования в качестве адсорбционных индикаторов.
| Индикатор | Определяемый ион | Ион осадитель | Изменение окраски |
| Ализариновый красный С | Желтая — розово-красная | ||
| Бромфеноловый синий | Желтая — зеленая | ||
| Сиреневая — желтая | |||
| Фиолетовая — сине-зеленая | |||
| Дифенилкарбазид | , , | Бесцветная — фиолетовая | |
| Конго красный | , , | Красная — синяя | |
| Синяя — красная | |||
| Флуоресцеин | , | Желто-зеленая — розовая | |
| Эозин | , | Желто-красная — красно фиолетовая | |
| Эритрозин | Красно-желтая — темно красная |
Наиболее используемые индикаторы pH
Примечательно, что помимо идентификационного свойства, данные соединения обладают хорошей красящей способностью, что позволяет использовать их для покраски тканей в текстильной промышленности. Из большого числа индикаторов цвета в химии самыми известными и используемыми являются метиловый оранжевый (метилоранж) и фенолфталеин. Большинство других хромофоров в настоящее время используются в смеси друг с другом, либо для специфических синтезов и реакции.
формы применения индикаторов, измерение ph анализ образцов
Индикаторы обычно используют, добавляя несколько капель водного или спиртового раствора, либо немного порошка (например, смесь мурексида с хлоридом натрия) к пробе исследуемого раствора.
При титровании, в аликвоту исследуемого раствора добавляют индикатор, и наблюдают за изменениями цвета в точке эквивалентности.
Другой способ применения — использование полосок бумаги, пропитанных раствором индикатора или смеси индикаторов и высушенных (Универсальный индикатор).
Метиловый оранжевый
Многие красители получили название благодаря своим основным цветам в нейтральной среде, что присуще и этому хромофору. Метиловый оранжевый является азокрасителем, имеющим группировку – N = N ‒ в своем составе, которая отвечает за переход цвета индикатора в красный в кислой среде, и в желтый — в щелочной. Сами азосоединения не являются сильными основаниями, однако присутствие электродонорных групп (‒ OH, ‒ NH2, ‒ NH (CH3), ‒ N (CH3)2 и др.) увеличивает основность одного из атомов азота, который становится способен присоединять протоны водорода по донорно-акцепторному принципу. Поэтому при изменении концентраций ионов H+ в растворе можно наблюдать изменение окраски кислотно-основного индикатора.
главная > справочник > химическая энциклопедия:Индикаторы
Индикаторы (позднелат. indicator — указатель), химические вещества, изменяющие окраску, люминесценцию или образующие осадок при изменении концентрации какого-либо компонента в растворе. Указывают на определенное состояние системы или на момент достижения этого состояния.
Различают индикаторы обратимые и необратимые. Изменение окраски первых при изменении состояния системы может быть повторено многократно. Необратимые индикаторы подвергаются необратимым химическим превращениям, например, азосоединения при окислении ионами BrO3- разрушаются. Индикаторы. которые вводят в исследуемый раствор, называют внутренними, в отличие от внешних, реакцию с которыми проводят вне анализируемой смеси. В последнем случае одну или несколько капель анализируемого раствора помещают на бумажку, пропитанную индикатором, или смешивают их на белой фарфоровой пластинке с каплей индикатора. Индикаторы применяют чаще всего для установления конца какой-либо химической реакции, главным образом конечной точки титрования (к. т. т.). В соответствии с титриметрическими методами различают кислотно-основные, адсорбционные, окислительно-восстановительные и комплексонометрические индикаторы. Кислотно-основные индикаторы представляют собой растворимые органические соединения, которые меняют свой цвет или люминесценцию в зависимости от концентрации ионов Н+ (рН среды). Применение для установления конца реакции между кислотами и основаниями (в том числе при кислотно-основном титровании) или других реакций, если в них участвуют ионы Н+, а также для колориметрического определения рН водных растворов. Наиболее важные кислотно-основные индикаторы приведены в табл. 1. Причина изменения цвета индикаторов в том, что присоединение или отдача протонов его молекулами связаны с заменой одних хромофорных групп другими или с появлением новых хромофорных групп. Если индикатор – слабая кислота HIn, то в водном растворе имеет место равновесие: HIn + Н2О D In- + Н3О+ . Если индикатор — слабое основание Штб тоЖ Шт + РБЫГИЮ2Б.ЫГИЮЩ В РШтБЫГЗЮ+Б.ЫГЗЮ + ОНБЫГЗЮ-Б.ЫГЗЮю В общем виде можно записать: Ina + Н2О D Inb
+
Н3О+, где Ina и Inb — соответственно кислая и основная формы индикаторов, которые окрашены различно. Константа равновесия этого процесса
К
ln
=
[Inb][H3O+]/[Ina] называется константой индикатора. Цвет раствора зависит от соотношения [Ina]/[Inb], которое определяется рН раствора.
Считают, что цвет одной формы индикатора заметен, если ее концентрация в 10 раз превышает концентрацию другой формы, то есть если отношение [Ina]/[Inb] = [H3O+]/Kln равно 0,1 или 10. Изменение цвета индикатора отмечается в области рН = рК
lп
b
1, который называют интервалом перехода индикатора. Изменение наиболее отчетливо, когда [Ina] = [Inb] и Кln = [Н3О]+, т.е. при рН = рКln. Значение рН, при котором обычно заканчивается титрование, называют показателем титрования р
Т.
Индикаторы для титрования подбирают таким образом, чтобы интервал перехода окраски включал значение рН, какое должен иметь раствор в точке эквивалентности. Часто это значение рН не совпадает с рТ используемого индикатора, что приводит к так называемой индикаторной ошибке. Если в к. т. т. остается избыток неоттитрованного слабого основания или кислоты, ошибка наз. соотв. основной или кислотной. Чувствительность индикаторов — концентрация (в моль/л) определяемого иона (в данном случае Н+ или ОН- ) в точке наиболее резкого перехода окраски. Различают: чувствительные к кислотам индикаторы с интервалом перехода в области щелочных значений рН (напр., фенолфталеин, тимолфталеин); чувствительные к основаниям индикаторы с интервалом перехода в кислой области (как у диметилового желтого, метилового оранжевого и др.); нейтральные индикаторы, интервал перехода которых находится около рН 7 (нейтральный красный, феноловый красный и др.). Индикаторы бывают с одной или двумя окрашенными формами; такие индикаторы называют соотв. одноцветными и двухцветными. Наиболее четкое изменение окраски наблюдалось бы у тех индикаторов, кислотная и основная формы которых окрашены в дополнительные цвета. Однако таких индикаторов существует. Поэтому, добавляя краситель, изменяют соответствующим образом окраски обеих форм. Так, у метилового красного переход от красного к желтому происходит в интервале 2 единиц рН, а если к раствору добавить метиленовый синий, то переход окраски от красно-фиолетовой к зеленой наблюдается резко и отчетливо при рН 5,3. Подобного эффекта можно добиться, если использовать смесь двух индикаторов, цвета которых дополняют дру. друга. Такие индикаторы называют смешанными (табл. 2).
Смеси индикаторов, которые непрерывно изменяют свой цвет во всей области значений рН от 1 до 14, называют универсальными. Их используют для приблизительной оценки рН растворов. На изменение окраски индикатора оказывают влияние его концентрации. Для двухцветных индикаторов чем выше концентрация, тем изменение окраски менее резко, так как спектры поглощения обеих форм накладываются друг на друга в большей степени и становится труднее определить изменение окраски. Обычно используют одно и то же минимальное (несколько капель раствора) количество индикатора.
Интервал перехода многих индикаторов зависит от температуры. Так, метиловый оранжевый меняет свою окраску при комнатной температуре в интервале рН 3,4-4,4, а при 100 °С в интервале рН 2,5-3,3. Это связано с изменением ионного произведения воды. Присутствующие в растворе коллоидные частицы адсорбируют индикаторы, что приводит к полному изменению его цвета. Для исключения ошибки в присутствии положительно заряженных коллоидных частиц следует применять индикаторы — основания, а в присутствии отрицательно заряженных – индикаторы — кислоты. При титровании в обычных условиях необходимо учитывать влияние растворенного СО2, особенно при использовании индикаторы с
рК
ln
>
4 (напр., метилового оранжевого, метилового красного, фенолфталеина.. Иногда СО2 предварительно удаляют кипячением или титруют раствор в отсутствие контакта с атмосферой. Влияние посторонних нейтральных электролитов (солевой эффект) проявляется в смещении равновесия индикаторы. В случае индикаторов-кислот интервал перехода смещается в более кислую область, а в случае индикаторов-оснований — в более щелочную. В зависимости от природы растворителя меняются окраски индикаторов, их
рК
ln и чувствительность. Так, метиловый красный в воде дает переход окраски при более высоких значениях активности ионов Н+ , чем бромфеноловый синий, а в этиленгликолевом растворе наоборот. В водно-метанольных и водно-этанольных растворах изменение по сравнению с водной средой незначительно. В спиртовой среде индикаторы-кислоты более чувствительны к ионам Н+, чем индикаторы-основания. Хотя при титровании в неводных средах обычно к. т. т. устанавливают потенциометрически с помощью стеклянного индикаторного электрода. используют также кислотно-основные индикаторы (табл. 3). Чаще всего для титрования слабых оснований применяют метиловый красный в диоксане или кристаллический фиолетовый в безводной СН3СООН; при титровании слабых кислот — тимоловый синий в ДМФА. Поведение индикаторов в неводной и водной средах аналогично. Напр., для слабой кислоты HIn в растворителе SН можно записать равновесие: HIn + SH D In- + SH2+. Механизм действия индикаторов такой же, как и в воде, только в неводных средах пользуются соответствующими шкалами кислотности (рНр). В качестве кислотно-основных индикаторов используют также люминесцентные индикаторы. меняющие цвет и интенсивность флуоресценции в зависимости от рН и позволяющие титровать сильно окрашенные и мутные растворы.
Для титрования слабых кислот применяются так называемые индикаторы помутнения вещества, образующие обратимые коллоидные системы, коагулирующие в очень узком интервале рН (например, изонитроацетил-n
-аминобензол дает муть при рН 10,7-11,0). В качестве кислотно-основных индикаторов можно использовать комплексы металлов с металлохромными индикаторами (см. ниже); эти комплексы, разрушаясь, изменяют окраску раствора в узком интервале рН.
Для определения органических кислот и оснований в воде в присутствии несмешивающегося с ней растворителя применяют так называемые амфииндикаторы, которые представляют собой соли индикаторов-кислот (например, тропеолина 00) с разл. орг. основаниями (напр., алкалоидами). Эти индикаторы хорошо растворимы в органических растворителях, плохо в воде; отличаются высокой чувствительностью. Адсорбционные индикаторы — вещества, способные адсорбироваться на поверхности осадка и менять при этом окраску или интенсивность люминесценции. Эти индикаторы, как правило, обратимы и используются в осадительном титровании В первую очередь осадком адсорбируются ионы, идентичные тем, которые входят в состав самого осадка, после чего адсорбируется индикаторы. Большая группа индикаторов — красители (табл. 4), адсорбирующиеся поверхностью осадка с образованием солей с ионами, содержащимися в осадке.
Например, раствор эозина розового цвета, который не меняется при добавлении AgNO3. Но при титровании раствором КВr выпадающий осадок адсорбирует ионы Ag+, которые присоединяют к себе анионы эозина. Осадок при этом становится красно-фиолетовым. В к. т. т., когда оттитрованы все ионы Ag+, окраска осадка исчезает и раствор становится снова розовым. Неорганические адсорбционные индикаторы образуют с ионами титранта цветной осадок или комплекс (как, например, применяемые в качестве индикаторов ионы СrО4- и SCN- в аргентометрии). В качестве адсорбционных индикаторов применяются также некоторые кислотно-основные, окислительно-восстановительные и комплексонометрические индикаторы, свойства которых (константы кислотной диссоциации, окислительно-восстановительные потенциалы и константы устойчивости комплексов с катионами металлов) в адсорбированном состоянии зависят от природы и концентрации ионов на поверхности осадка.
Окислительно-восстановительные индикаторы — вещества, способные изменять окраску в зависимости от окислительно-восстановительного потенциала раствора. Применяют для установления к. т. т. окислительно-восстановительного титрования и для колориметрического определения окислительно-восстановительного потенциала (преимущественно в биологии). Такими индикаторы служат, как правило, вещества, которые сами подвергаются окислению или восстановлению, причем окисленная (InOх) и восстановленная (InRed) формы имеют разные окраски. Для обратимых окислительно-восстановительных индикаторов можно записать: InOх +
ne
D InRed , где
п —
число электронов. При потенциале
Е
отношение концентраций обеих форм индикаторов определяется уравнение Нернста:
Где Eln — реальный окислительно-восстановительный потенциал индикатора, зависящий от состава раствора. Интервал перехода окраски практически наблюдается при изменении отношения [In0x]/[InRed] от 0,1 до 10, что при 25 °С соответствует DE (в В) = Eln b (0,059/n
). Потенциал, соответствующий самому резкому изменению цвета, равен Eln. При выборе индикаторов учитывают главным образом значения Eln, коэффициент молярного погашения обеих форм индикаторов и потенциал раствора в точке эквивалентности индикаторов. При титровании сильными окислителями (К2Сr2О7, КМnО4 и др.) применяют индикаторы, имеющие сравнительно высокие Eln, например, дифениламин и его производные; при титровании сильными восстановителями [солями Ti(III), V(II) и т.д.] применяют индикаторы с относительно низкими Eln, например, сафранин, метиленовый голубой (табл. 5).
Некоторые вещества изменяют свою окраску необратимо, например, при окислении разрушаются с образованием бесцветных продуктов, как индиго под действием гипохлоритов или нафтоловый сине-черный под действием ионов ВrО3.
Комплексонометрические индикаторы — вещества, образующие с ионами металлов (М) окрашенные комплексы, по цвету отличающиеся от самих индикаторов. Применяются для установления к. т. т. в комплексонометрии. Устойчивость комплексов металлов с индикаторы(In) меньше, чем соответствующих комплексoнатов, поэтому в к. т. т. комплексоны вытесняют индикаторы из комплексов с металлами. В момент изменения окраски в точке эквивалентности [In] = [MIn] и, следовательно, рМ = — lg KMln, где рМ = — lg[M] наз. точкой перехода
индикаторы
, КMln — константа устойчивости комплекса металла с индикатором. Ошибка при титровании связана с тем, что некоторое количество иона металла может присоединяться к индикатору, а не к титранту. Наиболее часто используют так называемые металлохромные индикаторы(табл. 6) — орг. вещества, образующие с катионами металлов растворимые в воде интенсивно окрашенные (el 104-105) внутрикомплексные соединения. Эти соединения должны быть достаточно устойчивы, чтобы образовываться при очень низких концентрациях ионов металлов. Индикатор и его комплекс должны находиться в истинном растворе. Дня повышения растворимости реагента и комплекса обычно вводят смешивающийся с водой растворитель. Комплекс металла с индикатором должен быть лабильным и быстро разрушаться под действием комплексона. Различают селективные и универсальные металлохромные индикаторы, взаимодействующие соотв. с небольшим числом или с многими катионами. К первым относятся, например,
тайрон,
галлион, ко вторым
— арсеназо
I,
пиридилазонафтол
(ПАН),
пирокатехиновый фиолетовый, ксиленоловый оранжевый, метилтимоловый синий, хромазурол
и др.
Иногда в качестве комплексонометрических индикаторов применяют комплексонат какого-либо иона (например, [CuY]2- , где Y — анион этилендиаминтетрауксусной кислоты) в смеси с металлохромным индикаторы
, например ПАН. При введении определяемого иона М2+ происходит реакция: М2+ + [CuY]2- + ПАН D [MY]2- + [СuПАН]+. При титровании каким-либо комплексоном в к. т. т. окраска раствора меняется от фиолетовой к желто-оранжевой, т.е. очень контрастно. При комплексонометрическом определении Сu используют в качестве индикатора ее комплекс с ПАН, адсорбированный на поверхности осажденного AgI. В этом случае можно определять Ag и Сu при совместном присутствии: в кислой среде раствором KI оттитровывают сначала ионы Ag, а затем комплексоном — ионы Сu.
Применяются также так называемые неокрашенные комплексонометрические индикаторы, избирательно взаимодействующие с ионами определяемого металла с образованием слабо окрашенных (el 103) комплексов, например, сульфосалициловая кислота
при титровании Fe (III). Флуоресцентные комплексонометрические индикаторы(или металлофлуоресцентные индикаторы) взаимодействуют с катионами металлов с образованием интенсивно флуоресцирующих хелатов. Впервые об индикаторах сообщил английский физик и химик Р. Бойль в 1664.
Лит.:
Индикаторы, пер. с англ., т. 1-2, М., 1976; Денеш И., Титрование в неводных средах, пер. с англ., М., 1971; Коренман И.М., Новые титриметрические методы, М., 1983.
Л. Н. Симонова.
выберите первую букву в названии статьи:
Подробнее о получении метилового оранжевого
Получают метиловый оранжевый в реакции с диазотирования сульфаниловой кислоты C6H4(SO3H)NH2 с последующим сочетанием с диметиланилином C6H5N(CH3)2. Сульфаниловую кислоту растворяют в растворе натриевой щелочи, добавляя нитрит натрия NaNO2, а затем охлаждают льдом для проведения синтеза в максимально близких к 0°C температурах и приливают соляную кислоту HCl. Далее готовят отдельный раствор диметиланилина в HCl, который охлажденным вливают в первый раствор, получая краситель. Его дополнительно подщелачивают, и из раствора выпадают в осадок темно-оранжевые кристаллы, которые по истечении нескольких часов отфильтровывают и сушат на водяной бане.
Как управлять цветом
Приложения для управления цветом, как и другие сторонние приложения для Android, рекомендуется загружать из Google Play Store. Предлагаем два варианта.
Light Manager
Это абсолютно бесплатное приложение, которое может докучать пользователю лишь рекламными баннерами. Чтобы от них избавиться, нужно обновить утилиту до платной версии.
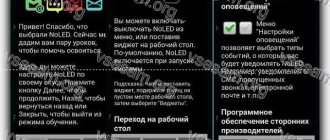
Первым делом Light Manager нуждается в предоставлении доступа ко всяким уведомлениям. Само приложение предложит сделать это. Далее нужно поэтапно делать так:
- перейти в «Настройки»;
- выбрать вкладку «Мелодии и уведомления»;
- выбрать вкладку «Доступ к уведомлениям»;
- поставить галочку рядом с Light Manager.
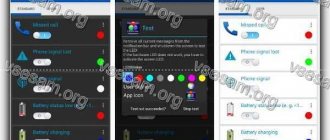
Настройки распределены по категориям, которые позволяют осуществлять индивидуальный выбор цвета и схем мигания. Если цвет рядом с приложением не отображается, значит он не настроен и используется по умолчанию. Активация, изменение цвета и деактивация уведомлений происходят в результате нажатия.
Light Flow Pro
Данное приложение действует подобно предыдущему. Оно предоставляет возможность сделать уведомления цикличными или показывать приоритет. Поддерживает до 6 сотен инструментов, а вот облегченная бесплатная версия (Light Flow Lite) способна поменять цвет светодиодов лишь для самых важных функций. Утилита запрашивает разрешения на доступ к приложениям, что устраивает не всех пользователей.
В отличие от «Менеджера» имеются средства манипуляции звуком и вибрацией. Совместимо не со всеми аппаратами. Разработчик приводит пример смартфонов НТС, которые поддерживают всего три цвета и поэтому их функциональность ограничена. Гаджеты других брендов также могут «удивить». Возможно светодиоды не будут мигать или не будут постоянно включенными. При возникновении проблем взаимодействия приложения и устройства рекомендуется отыскать в настройках «Прямой режим». При активации он управляет светодиодным фонариком.
После предоставления разрешения доступа нужно на главном экране приложения открыть «Уведомление». В нем будет список событий, индикацию которых можно настроить по своему усмотрению. Вслед за выбором типа настройки произойдет разделение уведомлений на вкладки. Можно установить собственные цвета.
Световые уведомления — не самая важная, но все равно полезная функция для устройств с Android. Они эффектно помогают распознавать тип уведомлений. Даже если смартфон находится в режиме ожидания и с отключенным звуком, пользователь сможет понять его сигналы и отреагировать.
Фенолфталеин
Свое название данный хромофор получил из сложения наименований двух реагентов, которые участвуют при его синтезе. Цвет индикатора примечателен изменением своей окраски в щелочной среде с приобретением малинового (красно-фиолетового, малиново-красного) оттенка, который обесцвечивается при сильном щелочении раствора. Фенолфталеин может принимать несколько форм в зависимости от показателей pH среды, причем в сильнокислых средах он имеет оранжевую окраску.
Этот хромофор получают путем конденсации фенола и фталиевого ангидрида в присутствии хлорида цинка ZnCl2 или концентрированной серной кислоты H2SO4. В твердом состоянии молекулы фенолфталеина являются бесцветными кристаллами.
Ранее фенолфталеин активно использовали при создании слабительных веществ, однако постепенно его применение значительно сократилось в связи с установленными кумулятивными свойствами.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ИНДИКАТОРЫ
Окислительно-восстановительные индикаторы — химические соединения, изменяющие окраску раствора в зависимости от значения окислительно-восстановительного потенциала. Они применяются в титриметрических методах анализа, а также в биологических исследованиях для колориметрического определения окислительно-восстановительного потенциала.
| Индикатор | Нормальный окислительно-восстановительный потенциал (при рН=7), В | Окраска раствора | |
| окислительная форма | восстановленная форма | ||
| Нейтральный красный | —0,330 | Красно-фиолетовая | Бесцветная |
| Сафранин Т | —0,289 | Коричневая | Бесцветная |
| Индигомоносульфонат калия | —0,160 | Синяя | Бесцветная |
| Индигодисульфонат калия | —0,125 | Синяя | Бесцветная |
| Индиготрисульфонат калия | —0,081 | Синяя | Бесцветная |
| Инднготетрасульфонат калия | —0,046 | Синяя | Бесцветная |
| Толуидиновый голубой | +0,007 | Синяя | Бесцветная |
| Тнонин | +0,06 | Фиолетовая | Бесцветная |
| о-Крезолиндофенолят натрия | +0,195 | Красновато-синяя | Бесцветная |
| 2,6-Днхлорфенолиндофенолят натрия | +0,217 | Красновато-синяя | Бесцветная |
| м-Бромфенолиндофенолят натрия | +0,248 | Красновато-синяя | Бесцветная |
| Дифеинлбензидин | +0,76 (кислый раствор) | Фиолетовая | Бесцветная |
Лакмус
Этот индикатор стал одним из первых реактивов, используемых на твердых носителях. Лакмус является сложной смесью природных соединений, которую получают из некоторых видов лишайников. Его используют не только как красящее вещество, но и как средство для определения pH среды. Это один из первых индикаторов, который начал использоваться человеком в химической практике: его применяют в виде водных растворов или пропитанных им полосок фильтровальной бумаги. Лакмус в твердом состоянии является темным порошком со слабым аммиачным запахом. При растворении в чистой воде цвет индикатора принимает фиолетовое окрашивание, а при подкислении дает красный цвет. В щелочной среде лакмус переходит в синий, что позволяет использовать его как универсальный индикатор для общего определения показателя среды.
Точно установить механизм и характер реакции, протекающих при изменении pH в структурах компонентов лакмуса не представляется возможным, так как в него может входить до 15 различных соединений, причем некоторые из них могут быть неразделимыми действующими веществами, что усложняет их индивидуальные исследования химических и физических свойств.
Настройка цвета светового индикатора
Несмотря на то, что цвет индикатора определён по умолчанию, можно его кастомизировать, то есть поменять по своему желанию
. Эта функция присутствует, к сожалению, не во всех телефонах линейки. Более дорогие, современные и функциональные модели (к примеру,
Xiaomi Redmi Note 4Х
или
Xiaomi Redmi Note 5
) имеют возможность сделать так, чтобы световой индикатор приобретал разные цвета в соответствии с предпочтениями пользователя. Палитра цветов зависит от модели гаджета. Как изменить цвет индикатора приложений?
- Открываем «Настройки» любым удобным способом.
- Переходим во «Все приложения» раздела «Приложения».
Выбираем любое приложение, для которого хотим установить световую индикацию, и кликаем на него.
Листаем и находим «Уведомления». Нажимаем.
Находим «Световой индикатор». Включаем. Если есть возможность (в нашем случае нет), выбираем цвет индикации уведомлений от этого приложения.
Чтобы изменить цвет индикации вызовов, сообщений и уведомлений от устройства, необходимо зайти в раздел «Световой индикатор» (опять же, он имеется не на всех моделях!) и под функциями включения LED выбрать желаемый цвет для каждой из категорий.
Если Ваше устройство лишено этой функции или палитра цветов слишком мала для Вас, можно установить приложения с ключевыми словами LED Control
в названии и расширить возможности гаджета.
Универсальная индикаторная бумага
С развитием науки и появлением индикаторных бумаг установление показателей среды многократно упростилось, поскольку теперь не нужно было иметь готовые жидкие реактивы для каких-либо полевых исследований, чем до сих пор успешно пользуются ученые и криминалисты. Так, на смену растворам пришли универсальные индикаторные бумаги, которые благодаря широкому спектру действия практически полностью убрали необходимость использования любых других кислотно-основных индикаторов.
Состав пропитанных полосок может отличаться у различных производителей, поэтому примерный список входящих веществ может быть следующим:
- фенолфталеин (0-3,0 и 8,2–11);
- (ди)метиловый желтый (2,9–4,0);
- метиловый оранжевый (3,1–4,4);
- метиловый красный (4,2–6,2);
- бромтимоловый синий (6,0–7,8);
- α‒нафтолфталеин (7,3–8,7);
- тимоловый синий (8,0–9,6);
- крезолфталеин (8,2–9,8).
На упаковке обязательно приведены эталоны цветной шкалы, позволяющие определить pH среды от 0 до 12 (где-то 14) с точностью до одной целой.
Помимо прочего, данные соединения могут использоваться совместно в водных и водно-спиртовых растворах, что делает применение таких смесей очень удобным. Однако некоторые из этих веществ могут быть плохо растворимы в воде, поэтому необходимо подбирать универсальный органический растворитель.
Благодаря своим свойствам кислотно-основные индикаторы нашли свое применение во многих областях науки, а их многообразие позволило создать универсальные смеси, чувствительные к широкой области показателей pH.
ФЛУОРЕСЦЕНТНЫЕ ИНДИКАТОРЫ
Некоторые химические соединения при воздействии на них ультрафиолетовых лучей обладают способностью при определенном значении pH вызывать флуоресценцию раствора или изменять ее цвет или оттенок.
Этим свойством пользуются для кислотно-щелочного титрования масел, мутных и сильно окрашенных растворов, поскольку обычные индикаторы для этих целей непригодны.
Работу с флуоресцентными индикаторами проводят при освещении исследуемого раствора ультрафиолетовым светом.
| Индикатор | Интервал pH изменения флуоресценции (в ультрафиолетовом свете) | Изменение цвета флуоресценции |
| 4-Этоксиакридон | 1,4-3,2 | Зеленый — синий |
| 2-Нафтиламин | 2,8—4,4 | Нарастание фиолетовой флуоресценции |
| Диметнлнафтэйродин | 3,2—3,8 | Лиловый — оранжевый |
| 1-Нафтиламнн | 3,4-4,8 | Нарастание синей флуоресценции |
| Акридин | 4,8—6,6 | Зеленый — фиолетовый |
| 3,6-Диоксифталимид | 6,0—8,0 | Желто-зеленый — желтый |
| 2,3-Дициангидрохинон | 6,8—8,8 | Синий — зеленый |
| Эухризин | 8,4—10,4 | Оранжевый — зеленый |
| 1,5-Нафтиламинсульфамид | 9,5—13,0 | Желтый — зеленый |
| СС-кислота (1,8-аминонафтол 2,4-дисульфокислота) | 10,0-12,0 | Фиолетовый — зеленый |
Как включить световой индикатор на Хуавей и Хонор
Как включить индикатор на Хонор и Хуавей? Чтобы активировать индикатор событий, необходимо выполнить следующие действия:
- Перейти в настройки.
- Зайти во вкладку «Приложения и оповещения».
- Перейдите в раздел «Уведомления и строка состояния».
- Активируйте опцию «Мигание».
После представленной процедуры при пропущенных событий светодиод будет гореть соответствующим оттенком. Например, при зарядке он оповестит о состоянии батареи, при не отвеченном звонке или сообщении начнет мигать зеленым.
Расшифровка сигналов
Каждый производитель предусматривает определенную расшифровку сигналов светового индикатора Honor 10 Lite или других моделей. Эти особенности необходимо знать перед тем, как поменять оттенок лампочки.
Основные правила:
- Красный. Свидетельствует об уменьшении заряда батарейки ниже 10-процентной отметки. Смартфон Honor требует быстрой зарядки. Второй вариант — устройство заряжается, а уровень заряда ниже 90% (касается только двухцветных вариантов)
- Оранжевый мигающий. Девайс заряжается, а уровень заряда от 10 до 90%. Пришло сообщение о новом уведомлении (касается двухцветных моделей).
- Зеленый. Цвет индикатора характерен для режима заряда. Он подтверждает, что телефон получил более 90%.
- Оранжевый. Зажигается во время зарядки и показывает, что емкость аккумулятора находится в диапазоне от 10 до 90 процентов. Уведомлений нет. Актуально для 3-х цветных телефонов.
- Мигающий зеленый. Говорит о получении сообщения или пропущенном звонке. Уровень заряда больше 4%. Если зеленый светится во время зарядки, это свидетельствует о поступлении сообщения и заряде более 90%.
Зная указанные выше сигналы можно интерпретировать цвет индикатора на Honor и понимать, что означает тот или иной оттенок.
Как настроить
Для настройки рассматриваемой функции потребуется обратиться к конкретному приложению. Допустим, чтобы изменить параметры для Whatsapp:
- Зайдите в мессенджер.
- Нажмите на три точки сверху, чтобы вызвать меню и выбрать вкладку «Настройки».
- Нажмите на «Оповещения» – «Свет».
- Выберите понравившийся вариант, например, синий.
Как сбросить телефон Хонор и Хуавей до заводских настроек: делаем «hard reset»
Если смартфон не поддерживает выбранный оттенок, то лампочка будет мигать белым. Таким образом пользователь определит какая программа отправило сообщение, при этом не снимая блокировки с экрана.
ХЕМИЛЮМИНЕСЦЕНТНЫЕ ИНДИКАТОРЫ
К этой группе индикаторов относятся вещества, способные при определенных значениях pH высвечивать видимым светом. Хемилюминесцентными индикаторами удобно пользоваться при работе с темными жидкостями, поскольку в данном случае в конечной точке титрования возникает свечение.
| Индикатор | pH начала свечения |
| Диметилбисакриден | Около 9,0 |
| Лофин | 8,9—9,4 |
| Люминол | 8,0—8,5 |
| Люцигенин | 9,0-10,0 |
- Как сделать охлаждающую смесь >>